
发布日期:2023-08-07浏览次数:620来源:蓝景科信
体细胞胚胎发生(Somatic embryogenesis, SE)可以不经过配子融合,由体细胞分化发育成整个植株。SE是一个多因素的发育过程,也是研究细胞全能性的理想模型。目前,SE在多个领域得到了应用,例如:种质保护、人工种子生产、单倍体育种、无性繁殖,以及作为植物生物技术研究领域的平台工具。然而,目前对SE调控机制的理解仅限于少数模式植物(例如:拟南芥),而且不同物种之间SE调控机制存在很大差异。因此,深入研究重要经济作物棉花的SE调控机制对棉花育种和繁殖具有重要的意义。
2023年7月11日,郑州大学与中棉所棉花生物学国家重点实验室的研究成果发表在New Phytologist(IF=9.4,Q1区)期刊上,题目为“GhRCD1 regulates cotton somatic embryogenesis by modulating the GhMYC3-GhMYB44-GhLBD18 transcriptional cascade”。该研究使用DNA亲和纯化测序(DAP-seq)技术鉴定了陆地棉GhMYC3的结合基序和靶基因。揭示了GhRCD1-GhMYC3-GhMYB44-GhLBD18转录级联调控棉花SE的分子机制,为细胞全能性以及棉花基因工程研究提供了新思路。

1. GhMYC3是棉花SE过程中一个重要的调控因子
通过序列比对和系统发育分析,在陆地棉中筛选到一个与Homo-MYC具有高度系统发育相似性的同源基因GhMYC3,具有1个bHLH和1个bHLH-MYC_N结构域。于是假设GhMYC3在决定细胞命运方面具有与人类MYC相似的生理功能。
为研究GhMYC3对SE过程中细胞命运转变的影响,构建了过表达GhMYC3的棉花转基因系(OE-GhMYC3)。表型分析发现过表达GhMYC3显著诱导了SE,促进愈伤组织生长。随后,GhMYC3的RNAi细胞系(Ri-MYC3)表型分析发现Ri-GhMYC3与WT的愈伤组织形成率一致,但新鲜愈伤组织的重量(FW)略轻,胚性愈伤组织(EC)分化率显著降低。以上结果表明,GhMYC3促进棉花体细胞向愈伤组织的去分化,但阻止了向EC的转变过程。
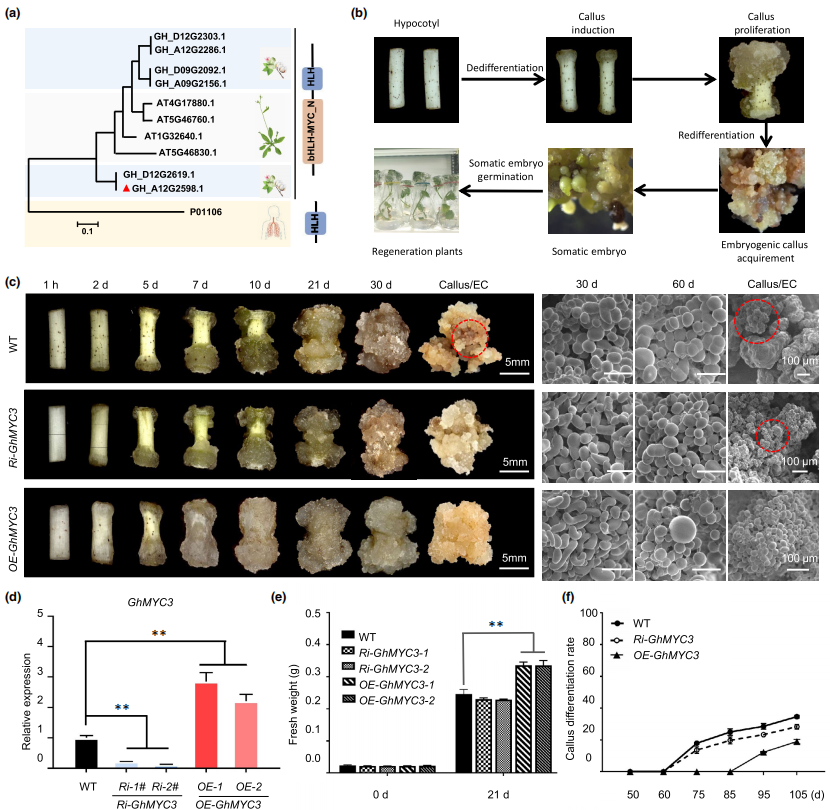
GhMYC3调控棉花SE过程
(a) 智人、陆地棉、拟南芥中MYC蛋白的系统发育分析。(b) 棉花SE过程示意图。下胚轴作为外植体,用愈伤组织诱导培养基培养,体细胞去分化形成愈伤组织,在60-90天的生长过程中,增殖的愈伤组织重新分化为EC,EC发育成体细胞胚,而后在体细胞胚诱导培养基上萌发为幼苗。(c) WT、OE-GhMYC3、Ri-GhMYC3在EC分化过程中的形态差异。(d) 长日照下生长的WT、OE-GhMYC3、Ri-GhMYC3植株叶片组织中GhMYC3的相对表达量。(e) WT、OE-GhMYC3、Ri-GhMYC3愈伤组织的FW。(f) WT、OE-GhMYC3、Ri-GhMYC3的EC分化率。
2. GhMYC3直接与GhMYB44和GhLBD18的启动子结合,调控其表达
DAP-seq分析鉴定了GhMYC3的DNA结合基序及其下游靶基因。鉴于愈伤组织形成和根系生长具有共同的调控途径,作者鉴定到了与根系发育和生长素信号通路有关的2个靶基因GhMYB44和GhLBD18。亚细胞定位分析发现GhMYC3、GhMYB44和GhLBD18主要表达于细胞核。在GhMYB44和GhLBD18的启动子中存在与GhMYC3结合的G-box(CACGTT)元件。酵母单杂交(Y1H)和电泳迁移率(EMSA)实验验证了GhMYC3特异性地结合GhMYB44和GhLBD18启动子中的G-box基序。另外,烟草叶片瞬时表达分析发现GhMYC3以G-box依赖的方式激活GhLBD18的转录,抑制GhMYB44的转录。
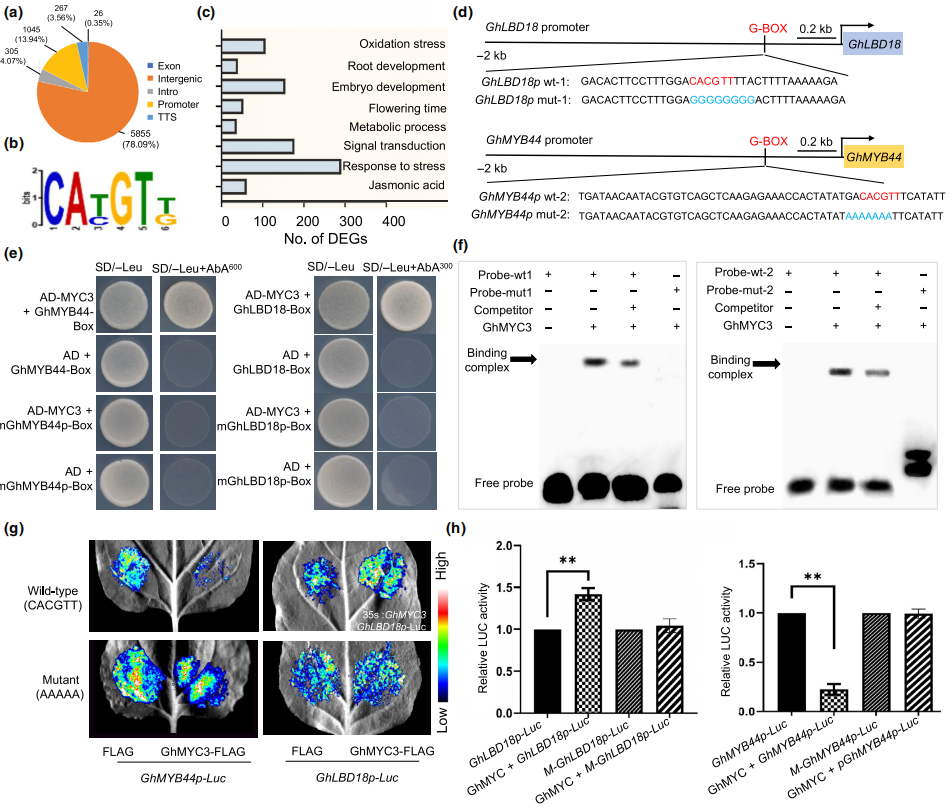
GhMYC3直接结合并调控GhMYB44和GhLBD18的转录
(a) GhMYC3的结合序列在基因组上的分布。(b) GhMYC3的主要结合基序CA T/C GT T/G。(c) GhMYC3下游基因的GO富集分析。(d) GhMYB44和GhLBD18启动子序列中包含G-box基序。(e) Y1H实验。(f) EMSA实验。(g-h) 烟草叶片瞬时表达分析及LUC荧光强度统计。
3. GhMYB44与GhLBD18的启动子直接相互作用,抑制其表达
DAP-seq分析发现在GhLBD18启动子中存在MYB转录因子结合位点。Y1H和EMSA实验验证了GhMYB44与GhLBD18启动子的直接结合。瞬时基因表达分析表明GhMYB44通过直接结合GhLBD18的启动子序列抑制其表达。以上结果表明,GhMYC3除了通过与GhLBD18启动子特定位点结合直接激活GhLBD18的表达外,还通过GhMYB44-GhLBD18转录级联信号间接调控GhLBD18的表达。
4. GhMYB44通过GhLBD18调控SE过程
利用OE-GhMYB44、SRDX-GhMYB44(特异性沉默系)和OEGhLBD18棉花株系进一步研究MYB44调控SE的过程。与WT相比,在OE-GhMYB44中愈伤组织起始延缓,愈伤组织增殖减弱,EC分化加速;相反,在SRDX-GhMYB44和OE-GhLBD18中愈伤组织起始提前,愈伤组织增殖增强,EC分化延迟。因此,GhMYB44在GhLBD18的上游发挥作用,在愈伤组织起始、愈伤细胞增殖和愈伤组织向EC的转变过程中控制细胞命运的决定。
5. GhRCD1与GhMYC3相互作用调节SE过程
采用酵母双杂交(Y2H)鉴定到在SE过程中与GhMYC3互作的蛋白GhRCD1,该蛋白在愈伤组织和EC形成的不同阶段均被诱导,但在体细胞胚中保持较低水平。双分子荧光互补(BiFC)实验、Pull down实验、LUC互补实验证明了GhMYC3与GhRCD1蛋白有相互作用。GhRCD1的敲除突变体(KO-GhRCD1)和过表达转基因系(OE-GhRCD1)实验分析发现,与WT相比KO-GhRCD1表现出愈伤组织起始提早,生长加快,FW增加;而与WT和KO-GhRCD1相比,OE-GhRCD1表现为愈伤组织起始延迟,增殖减少,EC分化率降低。结果表明,RCD1的适当表达对SE过程至关重要,但RCD1的过表达或突变均不利于愈伤组织细胞的命运转变过程。
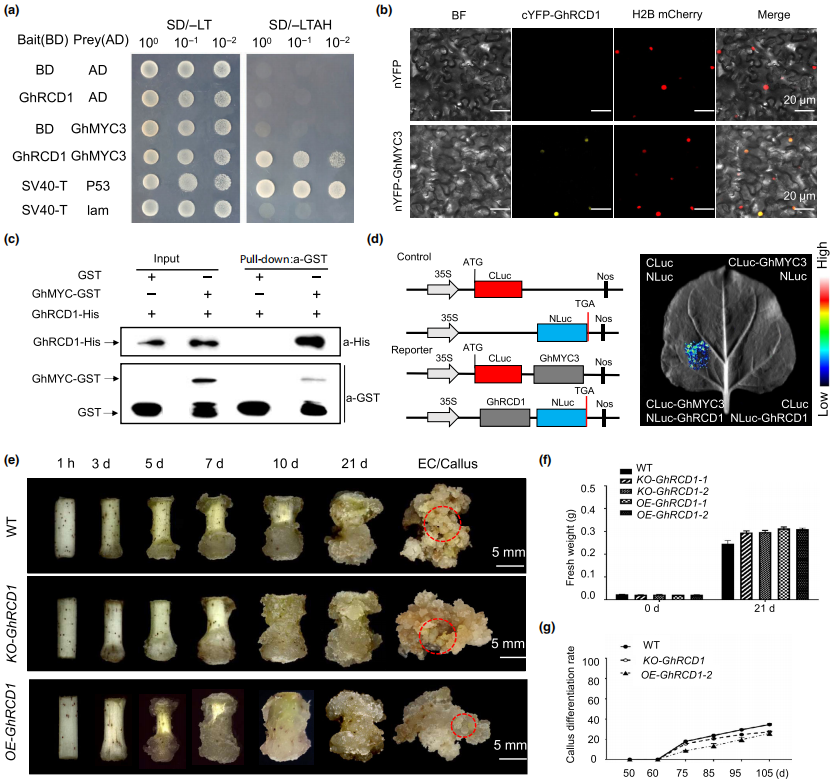
GhRCD1与GhMYC3有相互作用
(a) Y2H实验。(b) BiFC实验。(c) Pull down实验。(d) LUC互补实验。(e-g) KO-GhRCD1和OE-GhRCD1在SE不同发育阶段的形态学分析(e)、FW分析(f)和EC分化率分析(g)。
6. GhRCD1拮抗GhMYC3调控下游靶基因的转录能力
使用双荧光素酶报告(Dual-luc)实验检测GhRCD1是否影响GhMYC3对其下游靶点的转录调控。将LUC报告基因分别与GhMYB44和GhLBD18启动子融合,再通过瞬时转染测定启动子活性。GhMYC3的过表达抑制了GhMYB44启动子驱动的LUC表达,但过表达GhRCD1削弱了这种抑制作用;GhMYC3增强了GhLBD18启动子驱动的LUC表达,而过表达GhRCD1削弱了这种增强作用。此外,GhMYB44能够直接抑制GhLBD18的表达,但GhMYB44和GhMYC3共表达导致GhLBD18启动子驱动的LUC表达水平显著高于单独表达GhMYB44,这表明GhMYC3直接干扰了GhMYB44对GhLBD18的转录调控。qRT-PCR检测结果表明GhMYB44的表达水平与GhMYC3的表达呈负相关。GhLBD18在OE-GhMYC3和SRDX-GhMYB44中表达上调,而在Ri-GhMYC3细胞系中表达下调。总之,在SE过程中GhRCD1抑制GhMYC3对GhMYB44和GhLBD18的表达调控能力。
7. 由RCD1-MYC3-MYB44-LBD18级联介导的活性氧稳态调节细胞命运转变
利用ROS荧光探针H2DCF和BCIP-NBT检测SE不同发育阶段的ROS积累,发现ROS最初在外植体阶段的损伤组织中增加,细胞内ROS水平与愈伤组织细胞增殖呈正相关,第21 d时在发育的愈伤组织中观察到氧化爆发。在EC发育过程中,ROS在愈伤组织的胚性前区富集,但在其他部位枯竭。过表达GhMYC3和GhLBD18导致ROS积累,促进愈伤组织细胞增殖,然而过表达GhMYB44则相反。最后,该研究提出了一个愈伤组织形成和SE的模型。在下胚轴外植体培养的不同发育阶段,GhRCD1、GhMYC3、GhMYB44和GhLBD18的表达水平与细胞命运决定和细胞分化动态紧密相关。这些基因的精确时空表达可调节细胞内ROS的积累,进而影响SE过程中的细胞命运转变。
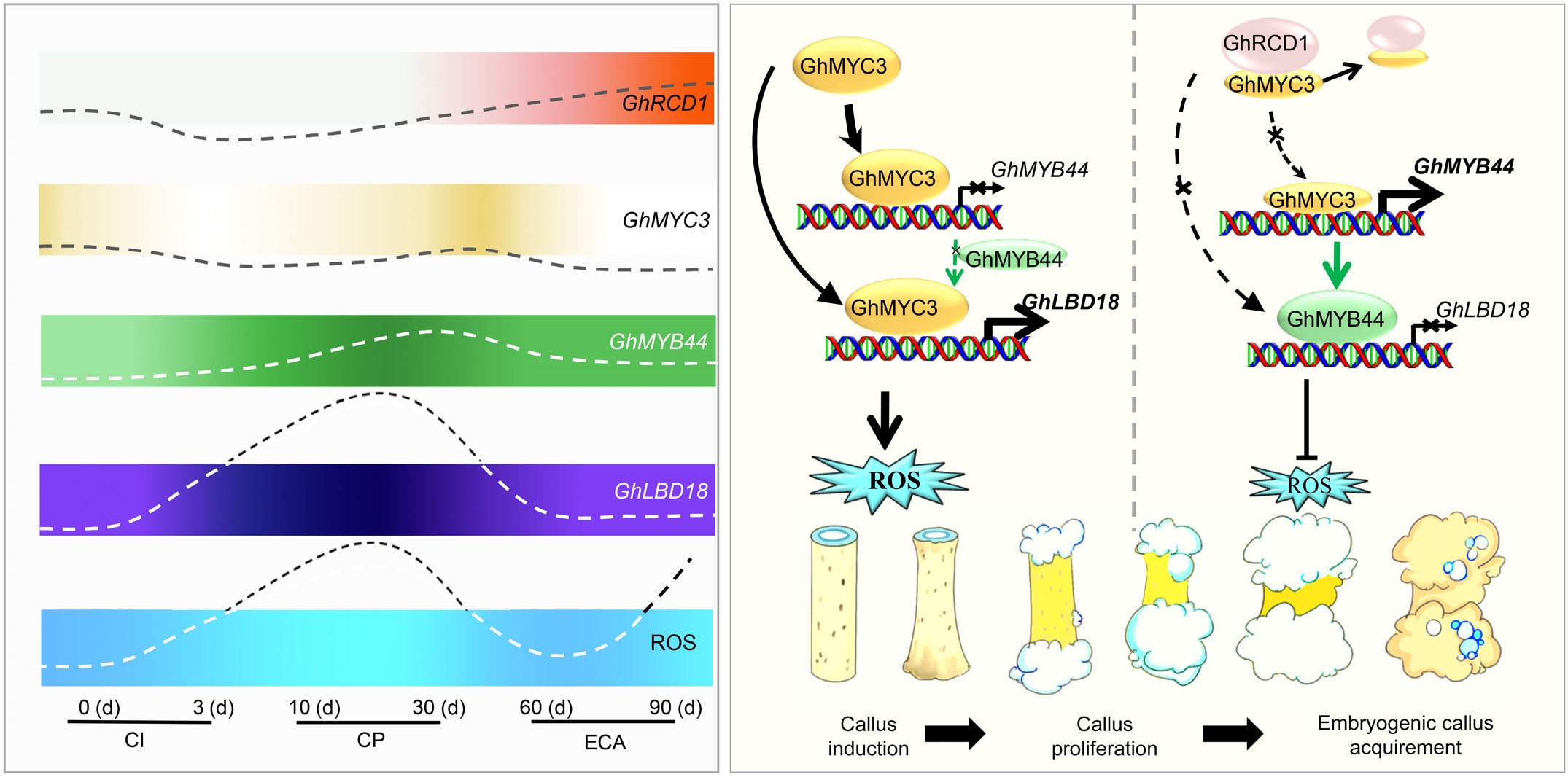
GhRCD1-GhMYC3-GhMYB44-GhLBD18信号级联调控SE的机制模型图
在愈伤组织诱导过程中,GhMYC3通过调控GhMYB44和GhLBD18的转录,进一步激活ROS依赖的信号通路,使ROS优先在诱导部位积累,并在愈伤组织增殖过程中达到峰值。在EC获得过程中,较高水平的GhRCD1可能抑制GhMYC3对GhMYB44和GhLBD18的转录调控,从而相应地减少ROS的积累,而且ROS在EC周围呈极性分布。
小结:该研究揭示了SE过程中细胞命运转变的调控网络。GhMYC3通过结合GhMYB44和GhLBD18启动子中的G-box元件调节其表达。GhRCD1拮抗GhMYC3对下游靶基因的转录调控能力。GhRCD1-GhMYC3-GhMYB44-GhLBD18组成的转录级联模块呈现时序表达模式,并时序性的调节细胞内ROS稳态,进而影响SE过程中细胞的命运。
参考文献:Yuan J, Liu X, Zhao H, Wang Y, Wei X, Wang P, Zhan J, Liu L, Li F, Ge X. GhRCD1 regulates cotton somatic embryogenesis by modulating the GhMYC3-GhMYB44-GhLBD18 transcriptional cascade. New Phytol. 2023. doi: 10.1111/nph.19120. (IF=10.323)