
发布日期:2025-06-13浏览次数:1185来源:蓝景科信
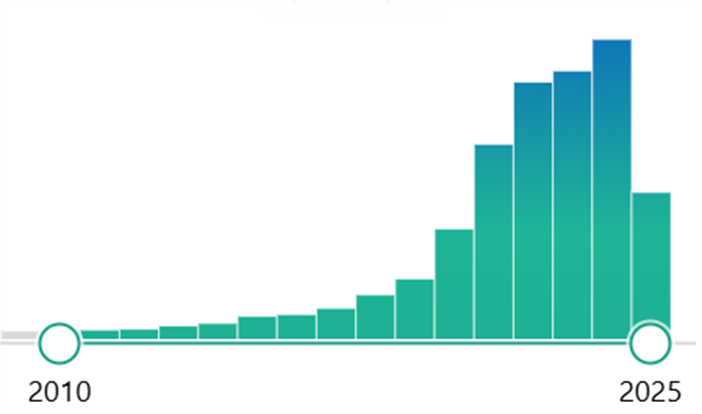
m6A(N6-Methyladenosine)甲基化修饰已成为近年来科研圈的“明星”(通过Pubmed检索"m6A"关键词,可以看出近10年内m6A的文章逐年增长,作为表观转录组中最丰富的化学修饰之一,m6A在多种生理过程中发挥着调控基因表达的关键作用。在了解m6A甲基化修饰之前,我们先了解一下什么是表观转录组。
表观转录组
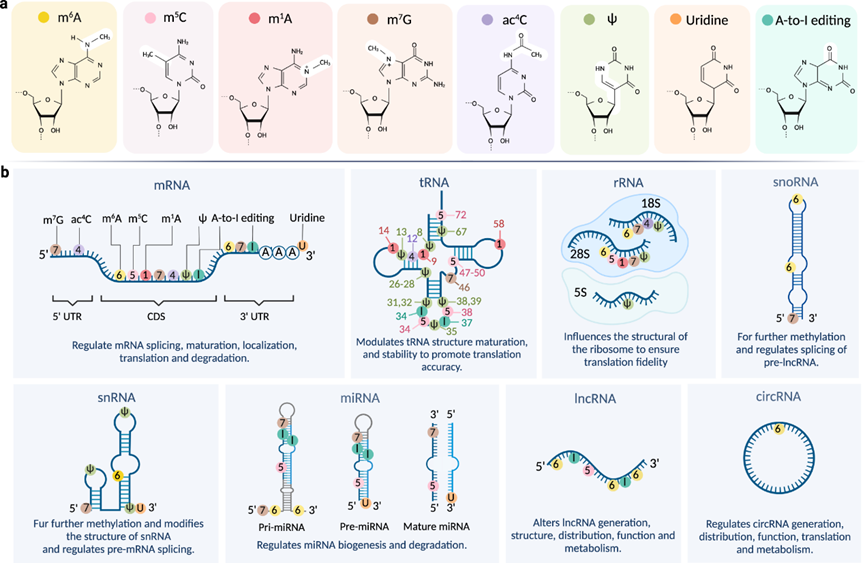
表观转录组(Epitranscriptome)指RNA分子上所有可逆化学修饰的集合,这些修饰不改变RNA序列,但可以通过调控基因表达(如翻译、降解、剪接等)发挥作用。RNA修饰广泛存在于各种RNA类型中,包括mRNA、tRNA、rRNA、snRNA、snoRNA、miRNA、siRNA、piRNA和lncRNA等。目前已知的 RNA修饰超过150种,常见类型包括甲基化(如m6A、m5C)、羟基化、假尿苷化(Ψ)等。其中RNA甲基化是最常见的修饰类型之一,在mRNA、tRNA等分子中占比较高(如哺乳动物 mRNA 中 m6A 修饰可占甲基化修饰的 80% 以上)。
RNA甲基化,是指在甲基转移酶(如 METTL 家族、CMTR 家族等)的催化下,将甲基基团(-CH3)通过共价键连接到RNA分子中核苷酸的特定原子上的修饰过程。RNA 甲基化修饰存在多种类型,包括 m6A、m5C、m1A、m7G 等。
m6A甲基化修饰
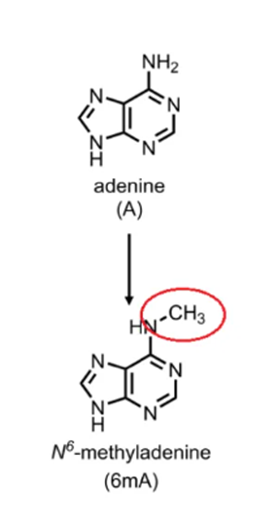
m6A甲基化修饰即RNA分子腺嘌呤第6位氮原子(N6位)上的甲基化修饰。m6A甲基化修饰是真核生物mRNA最普遍的内部修饰之一,约占到mRNA甲基化修饰的80%。m6A在调控基因表达(如调节mRNA可变剪切、稳定性、降解速率及翻译效率等)中起着重要作用。
m6A修饰主要发生在RRACH(R = G或A,H = A、C或U )这类motif上,这类motif主要在mRNA的终止密码子和3’UTR处富集,即m6A主要发生在终止密码子和3’UTR附近。
研究表明,m6A最主要的功能是调控mRNA稳定性:在胞质中,m6A修饰可被阅读器蛋白YTHDF2识别,通过招募相关因子将mRNA富集至Processing body(P-body),从而加速其降解。此外,m6A修饰可通过改变RNA局部二级结构(如茎环结构),暴露或遮蔽microRNA的结合位点,进而调控microRNA介导的mRNA降解效率。在核内,m6A修饰被核内阅读器YTHDC1识别后,可通过招募剪接因子(如SRSF家族蛋白)调控RNA可变剪接,并与核输出受体NXF1互作促进mRNA出核,最终实现基因表达调控。值得注意的是,m6A与DNA甲基化之间存在双向互作网络,例如m6A甲基转移酶METTL3可通过稳定DNA甲基转移酶DNMT3A的mRNA,间接增强基因组DNA甲基化水平,而DNA甲基化状态也可通过表观遗传调控影响m6A相关酶的转录。
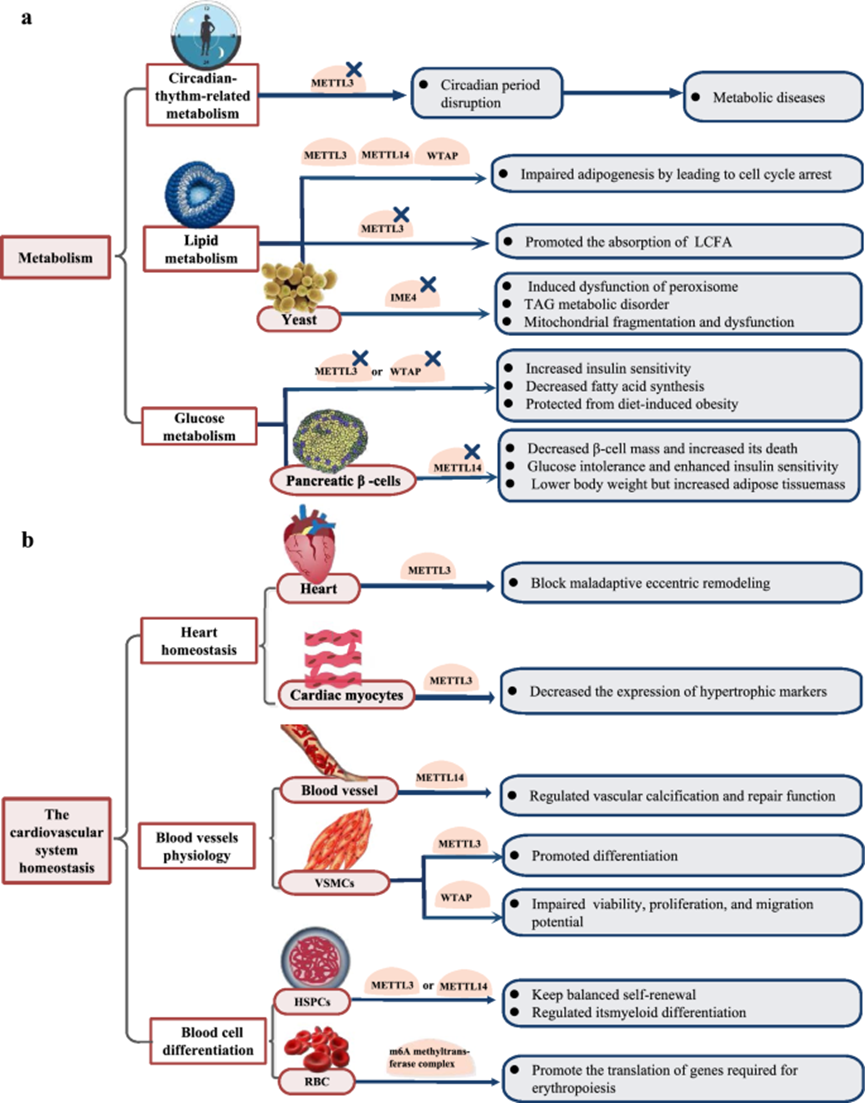
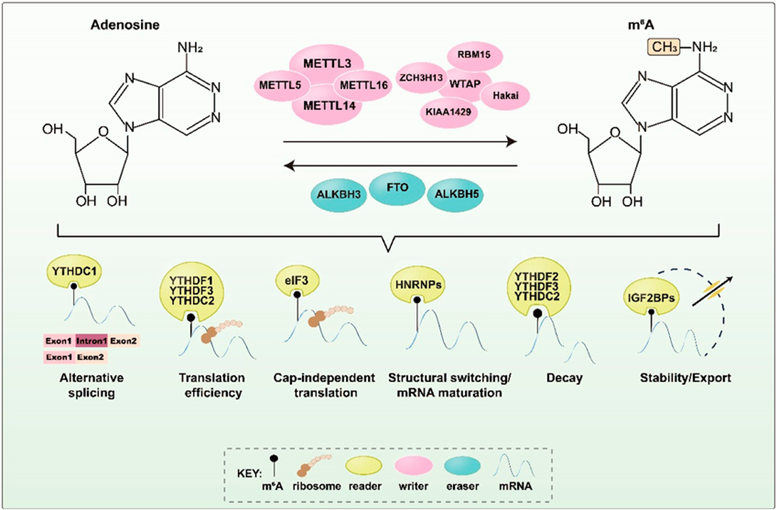
☟ 下图展示了目前已知的部分m6A的生物功能。
m6A的调控机制:
m6A甲基化修饰是动态可逆的生物过程,这种动态变化依赖于多种功能的酶进行调节,主要包括三种类型:甲基转移酶(Methyltransferases)、去甲基化酶(Demethylases)以及甲基化识别蛋白(Binding proteins)。
甲基转移酶(Writers)也称为 “写入器”,负责催化 mRNA 等 RNA 分子的碱基发生 m6A 甲基化修饰。核心成员包括METTL3/METTL14 复合物(催化 m6A 的直接添加),以及辅助因子WTAP、VIRMA、KIAA1429等(参与酶复合物定位或底物识别),此外还包括METTL16、RBM15/15B、ZC3H3、CBLL1等具有特定生物学功能的甲基转移酶。
去甲基化酶(Erasers)也称为 “擦除器”,负责催化 m6A 修饰的去除。目前已知的 m6A 去甲基化酶包括FTO和ALKBH5,可特异性移除 mRNA 中的甲基基团,实现修饰的动态调控。
m6A 识别蛋白(Readers)也称为 “阅读器”,通过特异性结构域识别m6A修饰的RNA,招募下游效应因子或改变RNA构象,从而调控mRNA的稳定性、剪接、翻译等过程。主要分为两类:
1、含YTH结构域的蛋白:
• 胞质型:YTHDF1(促进翻译)、YTHDF2(介导mRNA降解)、YTHDF3(协同前两者功能);
• 核内型:YTHDC1(调控剪接和出核)、YTHDC2(参与翻译起始)。
2、非YTH结构域的蛋白:
• IGF2BP1/2/3(通过m6A修饰增强mRNA稳定性);
• HNRNPA2B1(识别m6A并调控靶基因的选择性剪接)。
不同物种中,m6A 阅读器的功能存在特异性:例如,高海拔哺乳动物通过YTHDF1 识别缺氧相关基因(如 HIF-1α)mRNA 的 m6A 修饰,增强其翻译效率,从而抵抗缺氧诱导的细胞凋亡,体现了表观调控对环境适应的重要性。
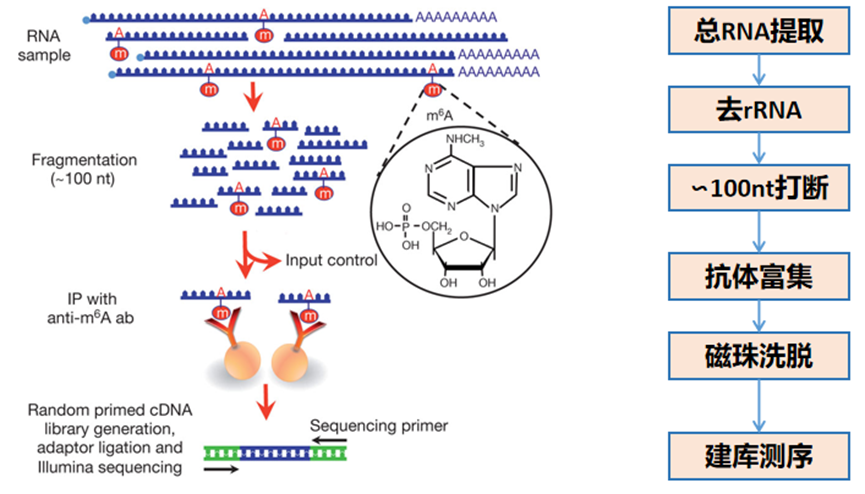
M6A甲基化测序(MeRIP-seq)技术
m6A修饰早在1970年代通过放射性标记技术被发现,而其在转录组中的全基因组分布特征最早通过二代测序(NGS)技术揭示。研究表明,在哺乳动物中,约25%的mRNA分子含有m6A修饰,平均每个转录本携带1-3个修饰位点,主要分布于终止密码子附近及3'UTR区域。
甲基化RNA免疫沉淀测序(MeRIP-seq/m6A-seq)通过特异性抗体富集含m6A的RNA片段,结合高通量测序可定位到约100 nt分辨率的修饰区域,已广泛用于m6A修饰的检测。
MeRIP-seq/m6A-seq技术原理为通过特异识别m6A修饰的抗体,对细胞内具有m6A修饰的RNA片段进行免疫共沉淀。对沉淀下来的RNA片段进行高通量测序,结合生物信息学分析,即可在全基因组范围内系统解析m6A修饰的分布特征、富集序列模式及潜在调控功能。该技术是目前研究 m6A 修饰最广泛使用的方法之一,已被应用于揭示m6A在发育、疾病等过程中的动态调控机制。
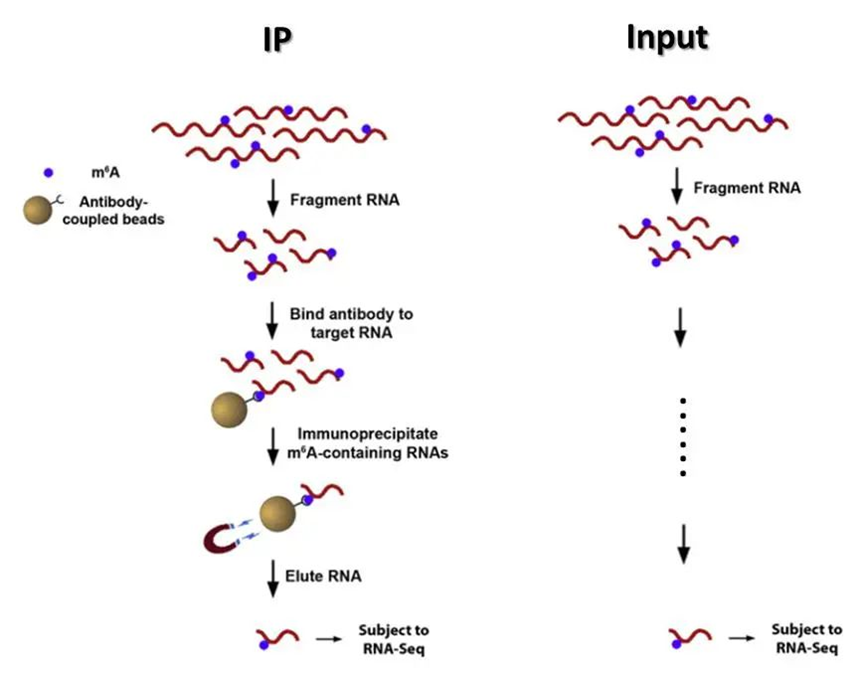
MeRIP-seq是基于免疫沉淀富集技术,该技术包括IP和input两个文库:IP文库是通过m6A特异性抗体富集含甲基化修饰的RNA片段,用于检测m6A修饰的分布;Input文库为未进行免疫沉淀的RNA样本(处理流程与IP一致),作为对照用于排除非特异性结合。 通过比较IP与Input文库的测序信号,可绘制全基因组范围内的m6A修饰图谱,单独的input文库可视为RNA-seq文库,可用于进行表达图谱的分析。
文库构建原理图如下:
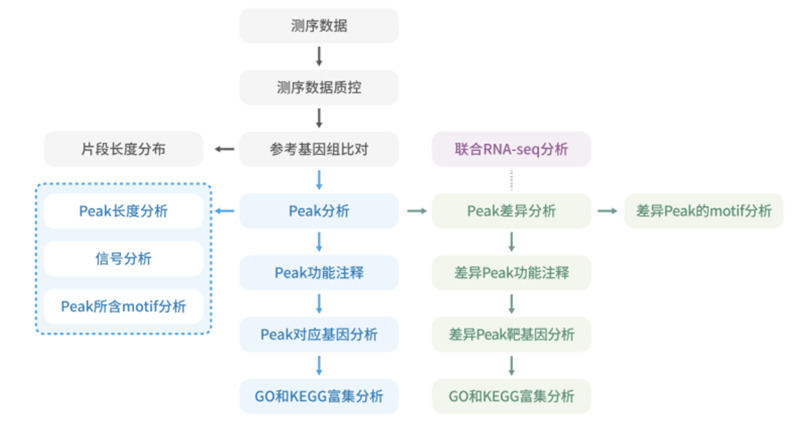
生信分析流程示意图如下:
今天为大家介绍的内容以基础知识为主,旨在为大家筑牢理论根基,希望能对大家有所助益。后续我们将为大家分享m6A的应用实例,敬请期待!
参考文献
1、Cui L, Ma R, Cai J, Guo C, Chen Z, Yao L, Wang Y, Fan R, Wang X, Shi Y. RNA modifications: importance in immune cell biology and related diseases. Signal Transduct Target Ther. 2022 Sep 22;7(1):334.
2、Jiang X, Liu B, Nie Z, Duan L, Xiong Q, Jin Z, Yang C, Chen Y. The role of m6A modification in the biological functions and diseases. Signal Transduct Target Ther. 2021 Feb 21;6(1):74.
3、Ma S, Chen C, Ji X, Liu J, Zhou Q, Wang G, Yuan W, Kan Q, Sun Z. The interplay between m6A RNA methylation and noncoding RNA in cancer. J Hematol Oncol. 2019 Nov 22;12(1):121.
4、Qin Y, Li L, Luo E, Hou J, Yan G, Wang D, Qiao Y, Tang C. Role of m6A RNA methylation in cardiovascular disease (Review). Int J Mol Med. 2020 Dec;46(6):1958-1972.
5、Gu J, Zhan Y, Zhuo L, Zhang Q, Li G, Li Q, Qi S, Zhu J, Lv Q, Shen Y, Guo Y, Liu S, Xie T, Sui X. Biological functions of m6A methyltransferases. Cell Biosci. 2021 Jan 11;11(1):15.
6、Zhou J, Han Y, Hou R. Potential role of N6-methyladenosine modification in the development of Parkinson's disease. Front Cell Dev Biol. 2023 Dec 13;11:1321995.