
发布日期:2025-06-16浏览次数:1223来源:蓝景科信
在生命科学领域,蛋白质与DNA的相互作用构成了生命活动的分子基础,精准调控着基因表达、细胞命运决定和遗传信息传递等关键生物学过程。这种精密的分子互作机制不仅维持着生物体的正常生理功能,更在揭示生命本质、开发疾病诊疗新策略(如靶向药物设计)、推动农业遗传改良(如作物抗逆基因调控)等领域提供了重要的理论依据。
当我们通过DAP-seq、ChIP-seq、Cut&Tag等高通量测序技术或者其他研究方法筛选到蛋白质与DNA的相互作用后,在进行点对点验证(即特定蛋白-特定 DNA 位点的互作验证)时,常用的经典方法包括:酵母单杂交系统、凝胶迁移实验(EMSA)、染色质免疫共沉淀-定量PCR(ChIP-qPCR)以及双荧光素酶报告基因实验。以下将对这些技术的原理和应用进行系统介绍。
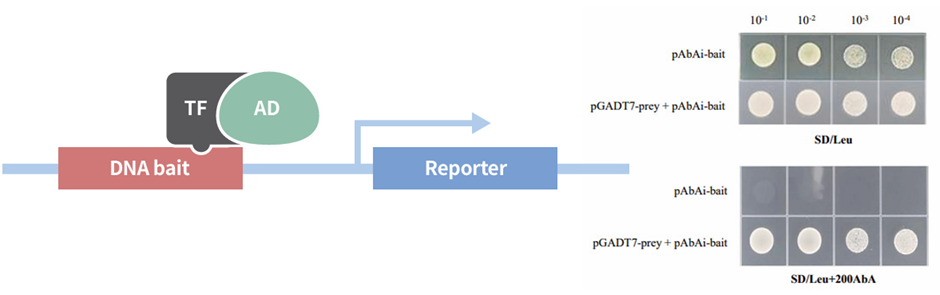
酵母单杂交系统(Yeast one-hybrid, Y1H)是解析细胞内DNA-蛋白质相互作用的经典分子生物学工具。其核心原理基于真核生物转录激活子的结构特征,这类转录激活子通常包含 独立发挥功能的DNA结合结构域(DNA Binding Domain,BD)和转录激活结构域(Transcription Activation Domain, AD)。
构建酵母单杂交体系时,将含有特定顺式作用元件的“诱饵”DNA序列整合进酵母基因组,使其与报告基因相连。同时,将潜在结合的转录因子(“猎物”)和转录激活结构域AD构建成融合表达载体,导入酵母细胞。若转录因子能特异性结合“诱饵”DNA,AD会招募转录复合物,启动报告基因表达。通过检测报告基因的表达水平,即可判断转录因子与 DNA 是否存在相互作用。
bait序列设计注意事项:
1. 在选取bait序列时,需明确研究目的,将与目标生物学过程相关的基因或DNA区域确定为候选序列。
2. 候选bait序列应具有高度特异性,对于转录因子而言,通常有保守的结合位点,可以在这个网站(JASPAR-A database of transcription factor binding profiles)预测转录因子与目标DNA区域的结合位点。
3. 其长度设定要科学,过短难以有效结合互作蛋白,过长则会增加操作难度,自激活和非特异性结合的几率,一般推荐bait序列长度在200-300 bp左右。
4. 还需考虑DNA的稳定性,避免选择易形成复杂二级结构的区域,因为这类结构可能干扰与转录因子的互作。
▶优势:
1. 生理相关性强:可在酵母细胞内模拟生理环境,检测转录因子与 DNA 的动态相互作用,为机制研究提供接近体内真实状态的数据。
2. 灵敏度高:能够检测低亲和力的弱相互作用,发现传统方法难以识别的分子关联。
3. 高通量:可同时筛选大量转录因子与 DNA 序列组合,显著提升基因调控网络研究的效率。
▶局限:
1. 自激活导致假阳性:诱饵DNA可能被酵母内源转录因子或其他蛋白非特异性结合,异常激活报告基因,产生假阳性结果。
2. 融合蛋白表达问题导致假阴性:若AD融合蛋白存在细胞毒性、或无法稳定表达、错误折叠、不能准确定位于酵母细胞核内,就会干扰其与靶元件的正常结合能力,产生假阴性结果,遗漏真实存在的相互作用。
凝胶迁移实验(Electrophoretic mobility shift assay, EMSA)是一种能够在体外直观展示蛋白质与DNA在体外相互作用的技术。其原理是基于非变性聚丙烯酰胺凝胶电泳,在电场作用下,DNA分子会依据自身大小和电荷在凝胶中发生迁移。当蛋白质与 DNA 特异性结合时,所形成的复合物分子量增加,电荷分布也会改变,进而导致迁移速率降低。在凝胶成像结果中,未结合蛋白质的DNA条带迁移距离较长,位置靠前;而结合了蛋白质的DNA条带迁移距离较短,位置靠后,此即“滞后条带”。通过对比添加蛋白质前后DNA条带的迁移情况,即可判断蛋白质与DNA之间是否存在相互作用。
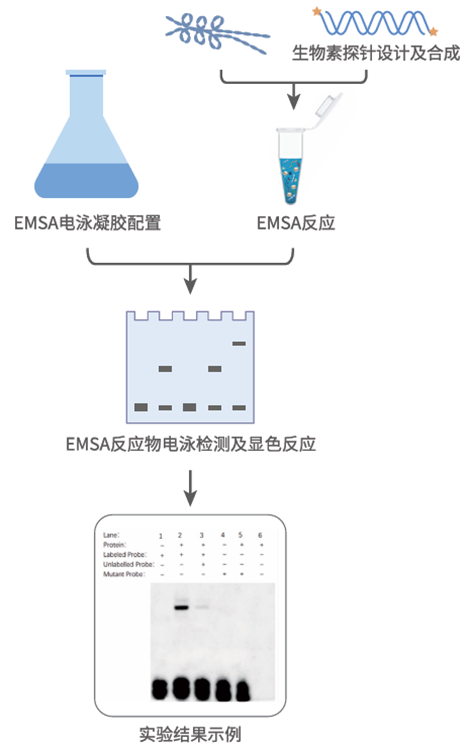
探针序列选择:需根据目标蛋白可能结合的DNA序列来设计探针,确保探针包含完整结合位点。若为已知转录因子结合序列,可直接采用经典结合序列(JASPAR-A database of transcription factor binding profiles);若未知,可通过生物信息学预测或初步筛选实验确定序列范围。
1. 探针长度:一般探针长度在30-100bp左右较为合适。过短可能导致结合特异性降低,过长则可能增加非特异性结合的概率。
2. 探针标记:常用放射性(如³²P)和非放射性(如生物素、地高辛)标记。放射性标记灵敏度高但有安全隐患,非放射性标记操作安全且易检测,可按需选择。标记应不影响探针与蛋白结合,一般连接在探针末端。
3. 对照设置:为确证实验结果的准确性与可靠性,需设置多种对照。空白对照,即不添加蛋白或探针,用于背景信号检测;阴性对照,只加入标记探针,以验证结合的特异性;阳性对照,使用已知可与探针结合的蛋白,用以验证实验体系的有效性。
4. 蛋白样品制备:若使用细胞裂解液,需留意裂解条件,添加蛋白酶、磷酸酶抑制剂,防止蛋白降解或修饰。体外表达的蛋白,尽量选择上清来纯化蛋白,通过预实验确定合适的蛋白浓度,浓度过高易致非特异性结合,过低则难以检测到信号。蛋白要新鲜制备或妥善保存,避免反复冻融。
▶优势:
1. 直接检测相互作用:可直观显示蛋白质与核酸结合后形成的复合物,通过电泳条带迁移率的改变确认结合现象。
2. 操作简便快捷:实验流程相对简单,无需复杂设备,实验周期较短(通常可在 1-2 天内完成)。
3. 适用性广:适用于多种生物体系(如细胞提取物、纯化蛋白等),可研究转录因子与启动子的结合、RNA 结合蛋白(RBP)与 RNA 的相互作用等。支持竞争实验(如加入未标记核酸探针验证特异性)或抗体超迁移实验(鉴定复合物中的蛋白成分)。
4. 定性分析灵活:可通过条带强度半定量分析结合亲和力或竞争抑制效应。
▶局限:
1. 非生理条件:体外实验无法完全模拟细胞内环境(如染色质结构、辅助因子等),结果可能与体内实际情况存在差异。
2. 定量能力有限:通常为定性或半定量,精确测定结合常数(Kd)需结合其他技术(如表面等离子共振 SPR)。
3. 假阳性/假阴性风险:非特异性结合可能导致假阳性;弱结合或动态复合物可能在电泳中解离,导致假阴性。
4. 探针依赖性:结果受核酸探针设计(长度、序列、标记效率)影响,短探针可能忽略蛋白结合的序列上下游的影响。
5. 低丰度蛋白检测困难:若样品中目标蛋白含量极低(如某些组织提取物),需大量样本或额外富集步骤,可能引入非特异性结合干扰。
染色质免疫共沉淀-实时荧光定量PCR(Chromatin immunoprecipitation-qPCR, ChIP-qPCR)是研究体内蛋白与DNA相互作用的关键技术。其原理是用甲醛交联细胞内蛋白-DNA复合体,维持天然相互作用状态;随后通过超声或核酸酶处理将染色质裂解为片段化DNA。接着利用目的蛋白特异性抗体进行免疫沉淀,捕获与目标蛋白结合的DNA片段。免疫沉淀后通过解交联释放DNA,经纯化后采用qPCR技术对特定DNA序列进行定量检测,通过对比IgG对照组的qPCR信号强度,可判断目标蛋白与特定DNA序列的结合情况及相互作用强度。
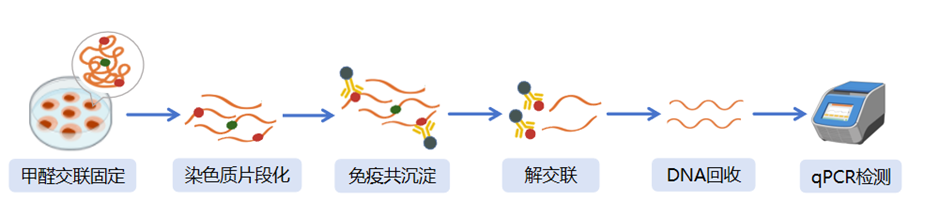
在ChIP-qPCR实验里,Ct值是数据解读的关键。Ct值越小,表明目标DNA起始含量越高,蛋白与DNA相互作用越强。常用Percent Input法或富集倍数法对ChIP-qPCR数据进行标准化分析:
Percent Input法:ChIP样本目标 DNA 信号值除以Input样本(未免疫沉淀的全染色质样品)的信号值,体现ChIP样本目标DNA相对Input样本的富集程度。
富集倍数法:ChIP样本目标DNA信号值除以阴性对照(如非特异性IgG免疫沉淀样本)信号值,量化目标DNA在ChIP样本中的特异性富集倍数。
实验过程中常见问题:
1. 抗体质量是影响实验结果的关键因素之一。若抗体特异性不足,可能与非目标蛋白结合,导致非特异性DNA 共沉淀,产生假阳性结果。因此,需选择经ChIP实验验证、特异性高的ChIP级抗体。
2. 交联过度会使染色质结构紧密,导致超声破碎效率降低,进而影响后续免疫沉淀效果。实验中需根据细胞类型与目标蛋白特性,优化交联时间和甲醛浓度。
3. 超声破碎条件不当会导致染色质片段化不均匀,影响实验结果。需通过预实验探索适宜的超声功率、时间及次数等条件。
4. ChIP 实验中染色质通常被打断为100–500 bp的片段,因此引物扩增产物长度建议为100–200 bp(最佳150 bp左右),确保目标区域包含在单个DNA片段内,避免跨片段扩增导致信号丢失。
5. 引物序列GC 含量 40%–60%,上下游引物 Tm 值差≤2℃,避免二聚体和非特异性结合。通过 NCBI Blast 等工具验证引物序列在基因组中的唯一性,避免与其他区域同源性过高(尤其是重复序列区域),导致非特异性扩增。
▶优势:
1. 高特异性:依赖特异性抗体富集目标蛋白结合的DNA片段,结合qPCR检测特定区域,减少非特异信号。
2. 体内真实性:在天然细胞环境中研究蛋白质与DNA的相互作用(如组蛋白修饰、转录因子结合),更贴近生理状态,避免体外实验(如 EMSA)的局限性。
3. 定量准确性:结合qPCR(实时荧光定量PCR)技术,可对目标DNA区域的富集程度进行准确定量,直接反映蛋白结合的相对强度(如结合位点的富集倍数)。
4. 应用范围广:可用于研究转录因子、辅因子、组蛋白修饰(如 H3K27me3、H3K4me3)、RNA 聚合酶等与基因组的结合,广泛应用于表观遗传学、基因表达调控研究。
5. 操作相对简单高效:相比 ChIP-seq,ChIP-qPCR 仅需普通 qPCR 仪,成本更低,数据分析更简单。
▶局限:
1. 抗体依赖性强:抗体特异性是关键,低效或非特异抗体会导致假阳性/假阴性。某些蛋白(如低丰度转录因子)可能难以有效沉淀。实验成败高度依赖抗体质量,低效或非特异抗体会导致假阳性/假阴性,部分蛋白(如低丰度转录因子)可能难以有效沉淀。
2. 仅检测已知位点(靶向分析):仅能检测已知或者候选的DNA区域(需设计特异性引物),无法进行全基因组扫描,需结合ChIP-seq技术进行全局分析。
3. 细胞异质性干扰:适用于均一细胞群体(如细胞系),在异质性组织样本(如肿瘤组织)中,目标细胞比例过低可能导致信号被稀释,需预先分离纯化目标细胞。
4. 实验操作复杂,变量多:
关键步骤影响结果:
- 交联效率(甲醛交联可能影响抗原表位)。
- 染色质片段化(超声破碎需优化,避免过度或不足)。
- DNA 回收率低可能导致数据偏差。
5. 无法提供单碱基分辨率:ChIP-qPCR 只能确定蛋白结合的大致区域(~100-500 bp),不能精确定位结合位点。
6. 无法区分直接与间接结合:检测到的蛋白-DNA结合可能为间接相互作用(如通过桥梁蛋白结合),需结合其他技术验证直接结合。
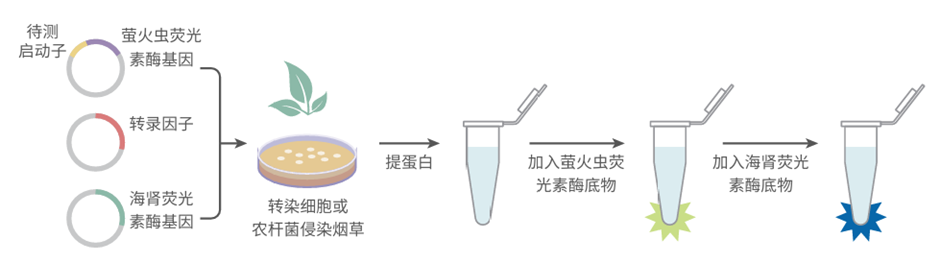
双荧光素酶报告实验(Dual-luciferase reporter assay,DLR)是一种在生物学研究中广泛应用的技术,主要用于解析基因表达调控机制,可定量评估转录因子与靶基因启动子的相互作用及启动子活性。
该实验通常使用萤火虫荧光素酶(Firefly Luciferase)和海肾荧光素酶(Renilla Luciferase)双报告系统:
l 萤火虫荧光素酶基因常作为报告基因,与目标基因的启动子序列构建在同一载体上,其表达直接受目标启动子调控。
l 海肾荧光素酶基因作为内参基因,由组成型启动子驱动,在细胞内稳定表达。
当细胞同时转染含有这两种基因的载体后,加入相应的荧光素底物,两种荧光素酶会催化底物发光。通过检测两种荧光信号的强度比值(Luc/Ren),可归一化处理实验数据,消除细胞转染效率、细胞活性等因素对实验结果的影响,从而准确反映目标启动子的活性。
双荧光素酶报告实验是分子生物学研究中用于验证基因调控元件与调控因子互作的重要工具,其典型应用场景如下:
1. 转录因子与调控序列的互作验证:将靶基因的调控序列(常见为启动子区域)插入报告基因载体,与转录因子表达载体共转染至细胞或烟草中。通过检测荧光素酶活性的变化,可分析转录因子对调控序列的激活或抑制作用,从而明确二者的调控关系。
2. miRNA与靶mRNA的互作验证:将目标mRNA的3'UTR序列连接到报告基因载体,同时共转染对应的microRNA。若荧光素酶活性显著降低,则表明该miRNA可能通过结合3'UTR调控靶基因的表达。同时可以增加3'UTR序列的突变组合进一步验证miRNA与3'UTR的调控关系。
3. miRNA与lncRNA的靶向互作验证:将目标lncRNA序列连接到报告基因载体中荧光素酶基因的3'UTR区域,通过检测荧光素酶活性的变化,可判断miRNA是否靶向调控目标lncRNA。同时可以增加lncRNA序列的突变组合进一步验证miRNA与lncRNA的调控关系。
4. 转录因子调控活性分析:将目标转录因子转染至细胞或烟草中,通过荧光信号的强弱可直接反映该转录因子的转录激活或抑制能力。
5. 启动子活性检测:将目标启动子序列构建至荧光素酶基因上游,通过检测荧光素酶表达水平,可定量评估该启动子的活性强度。
6. 启动子结构功能分析:通过对启动子区域(通常约2kb)进行分段截短或特定位点突变,并分别构建至报告载体中,可鉴定启动子的核心功能区域及关键调控位点。
7. 启动子单核苷酸多态性(SNP)分析:针对启动子区域存在的SNP位点,利用双荧光素酶报告系统比较不同基因型启动子的活性差异,可评估SNP对基因转录调控的影响。
1. 药物研发:评估候选药物对特定基因表达的影响,为药物筛选和开发提供依据。
2. 基因调控网络研究:探究不同转录因子间协同或拮抗作用,揭示基因调控网络机制。
3. 疾病发生发展分子机制研究:验证疾病相关基因变异对转录因子与DNA结合的影响,为疾病诊断和治疗提供新靶点和思路。
▶优势
1. 高灵敏度 & 宽动态范围:荧光素酶催化发光反应,信号强,检测限低至飞克级。
2. 双信号校正,减少实验误差:萤火虫荧光素酶反映目标调控元件的活性;海肾荧光素酶作为内参,可校正转染效率、细胞数量、裂解效率等变量,提高数据可比性。
3. 动态范围广:线性范围广(通常跨越4-6个数量级),信号强度与报告基因表达量呈线性关系,可检测倍数差异大的基因调控(如强激活 / 抑制作用)。
4. 操作相对简便:无需放射性同位素,实验周期短(24–48 小时内完成),适合高通量筛选(如药物、转录因子调控)。
5. 无内源性背景干扰:烟草和哺乳动物细胞通常不表达荧光素酶,本底信号极低。
▶局限
1.间接反映基因调控:仅检测报告基因的表达水平,无法直接反映内源性基因的真实调控(如染色质环境、剪接差异、翻译效率等)。
2.细胞模型局限性:依赖异源表达系统(如HEK293、HeLa细胞、烟草),可能与原代细胞或体内环境存在差异,并且质粒载体在细胞中为瞬时转染,无法完全模拟内源基因的染色质状态(如甲基化、组蛋白修饰)。
3.多因素干扰:转染过程可能引起细胞应激反应,影响内源通路;载体过表达可能导致非生理性结果。
4.检测时效性强:荧光信号衰减快,需在添加底物后立即检测,对操作速度要求高,不适用于长期效应研究
四种技术对比:
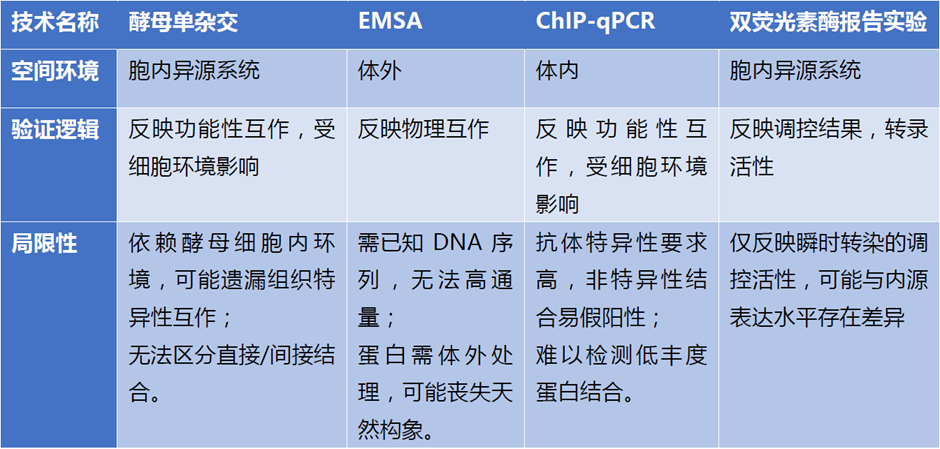
上述四种技术均可用于研究基因表达调控中的蛋白与DNA的相互作用或转录调控机制。然而,由于技术原理、实验条件的差异,蛋白的活性状态、检测范围及敏感度亦各有特点。为获取更可靠的生物学结论,通常需结合多种方法,并综合实验体系(如体内/体外环境)、蛋白表达状态(如天然构象/重组蛋白)等具体条件进行数据整合分析。